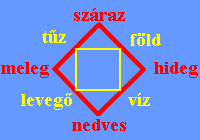
Tűz (plazma), víz (folyékony), föld (szilárd), levegő (gáz). Ezeknek az alapelemeknek a felsorolásából állt össze a rendszere. I.e. az V.-IV. században filozófáló görögök letették a modern anyagtudomány alapjait, ugyan is kitalálták az ATOMOT, ami oszthatatlant jelent. Persze ma már tudjuk, hogy nem így van, de azért az isteni részecske elmélet is kezd dugába dőlni, amiről feltételezték, hogy egy nagyon parányi alkotó, ami mindennek az alapja. Úgy látszik, hogy egy kicsit túllőttek a célon, na de a negatív eredménynek is van információértéke.
Epikürosz (i.e. 341-270) is érthette a természetet, mert felvetette, hogy léteznek kölcsönhatások, amiket ő kapcsokkal és horgokkal próbált meg magyarázni. Természetesen elmélete elég ingatag, de ettől még említésre méltó.
Aztán itt van még Arisztotelész (384-322), a mókamester, aki valószínűleg a másik politikai oldalt képviselhette, mert az oszthatatlanság elmélete helyett vissza- tért az eredetileg indiaiaktól származó őselemek rendszeréhez (tehát az ötlet nem saját termék), mely tagadja az osztahatatlanság tanát. Azért természe- tesen kiegészítette egy kicsit, mert a görögök filozófálással töltötték az egész napot. Természetes, hogy a középkorban is ezt a téves elméletet részesítették előnyben.
Az ókor azonban többet is adott nekünk holmi osztható és oszthatatlan elméleteknél, szám szerint kilenc elemmel ajándékoztak meg bennünket: arany, ezüst, réz, ón, ólom, higany, vas, kén és szén. A következő elemet csupán 1250-ben fedezték fel, majd kétszáz év múlva a következőt és lassan, persze nem túl nagy ütemben, elkezdődtött a többi elem felfedezése is. Szegény Giordano Bruno máglyán végezte, mert nem Arisztotelész tanait vallotta, hanem az atomelméletet. Nem ő volt az egyetlen, aki ebben a korban a hülyeség áldozatává vált.
Végül általánosan elfogadva az atomelméletet, jó irányban kezdtek a polihisztorok, később a tudósok kutatni, és kialakult mai képünk az atomról.
A model megtévesztő és nem fedi a valóságot
2 elektron a belső s orbitálon
2 elektron a következő szintű s orbitálon
2 elektron a legkisebb szintű p orbitálon
Ezen a modellen jól látható, hogyan különülnek el egymástól a héjak, de azokon belül már nem szemlélteti az alhéjakat. Az atommaghoz legközelebb eső gyűrűben az 1s orbitált látható. A rózsaszín gyűrűben már a 2s és a 2p orbitál együtt van jelen, ők alkotják az L héjat. A következő (M) héj szintén együtt tartalmazza a 3s és 3p orbitált, de ebben az esetben mindössze 3 elektron található ezen az energiaszinten (ami azt jelenti, hogy ez az elem az alumínium).
A lítium elemnél jól látszik, hogyan követik egymást az 1s és 2s energiaszintek.
Az elektronok a teljes térrészben mozognak, nem csak egy körpá- lyán. Míg az 1s orbitál önmagában alkotja a K héjat, a 2s (amin most 1 elektron tartózkodik) csak egy része az L héjnak.
Ezen a szén atomon az elektron és az atommag mérete közti különbséget igyekeztek szemléltetni. Szinte olyan az elektronfelhő, mint egy erőtér. Mivel gyorsan mozog, ezért egyszerre fejti ki hatását minden irányban, azon az elektronfelhőn belül, ahol mozog, de erőtérről még sem beszélhetünk, mert ha tömege elhanyagolható is, attől még van, és ezért formája anyagi jellegű.
Ha bár ez az argon modell nem fedi tökéletesen a valóságot, még is jól szemlélteti a p orbitálokat a térben. Ebből is jól látszik, hogy azok az energiaszintek, amik az atommagtól különböző távolságra helyezkednek el, nem mind gömb alakú.
Periódusos rendszerek
 | ||
| Az elemek első dokumentációinak egyike |
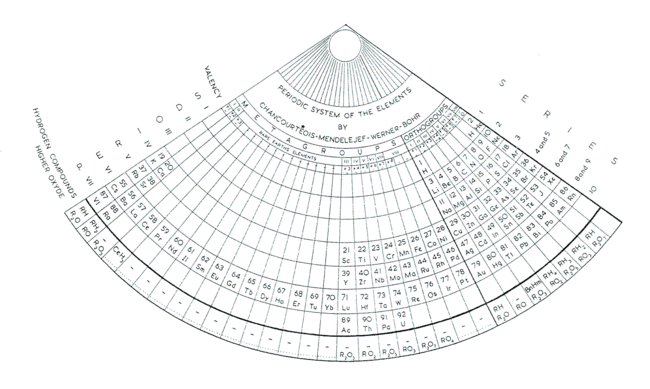
A Mengyelejev féle periódusos rendszer eredetileg 63 elemet tartalmazott, ellenben Dimitrij Ivanovics Mengyelejev a hianyzó elemeknek üresen hagya a helyet a táblázatban.
 Lothar Mayer, német kémikus egy másik úttörője a periódusos rendszernek, aki Men- gyelejevhez hasonlóan rájött az elemek pe- riodicitására, de rend- szerét csak az orosz tudós megjelent táblá- zata után publikálta. Mellesleg benne nem merült fel a fel nem fe- dezett elemek rendsze- rezése.
Lothar Mayer, német kémikus egy másik úttörője a periódusos rendszernek, aki Men- gyelejevhez hasonlóan rájött az elemek pe- riodicitására, de rend- szerét csak az orosz tudós megjelent táblá- zata után publikálta. Mellesleg benne nem merült fel a fel nem fe- dezett elemek rendsze- rezése.A periódusosok különböző rendszerezései
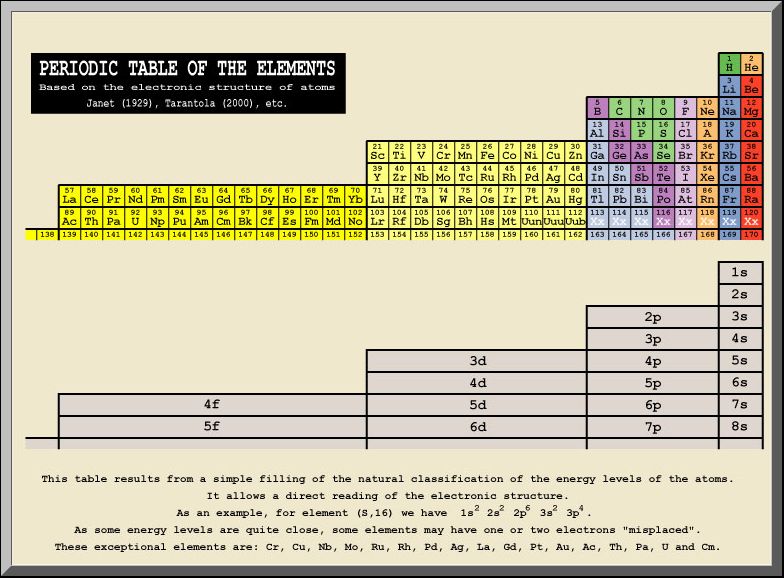 | ||
| A Mengyelejev rendszer szabályaira alapozódó Albert Tarantola féle táblázat a héjak energiaszintjeire helyezi a hangsúlyt. |
Dr. Timoti Stove rendszerén az elemek utolsó elektronnal rendelkező orbitáljuknak megfelelően helyezkednek el. Ha ábrázolnánk az elektronhéjakat és sorba feltüntetnénk az elektronokat, akkor a megfelelő elem táblázatban elfoglalt helyére esne.
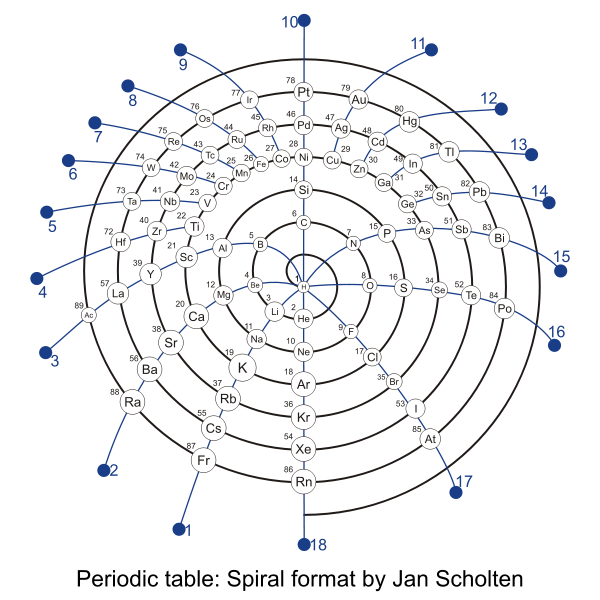
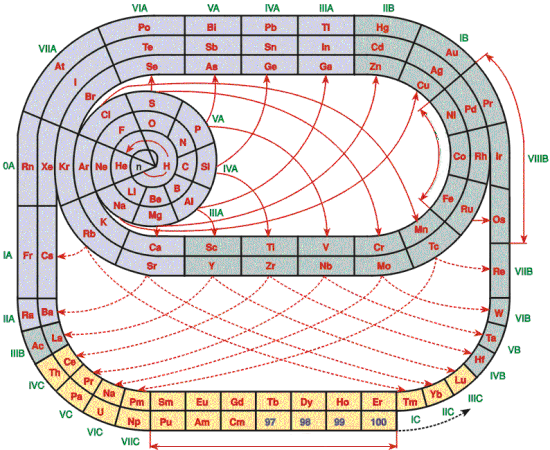
 Prof. Theodor Benfey az energiaszinteknek megfelelően, spirális a- lakban, lényegében nö- vekvő sorrendbe rakta az elemeket. Azok az elemek, amik sok elekt- ronnak adnak helyet a d és f orbitáljaikon, a ki- türemkedésekben kap- tak helyet. Ezen felül még látható azoknak az elemeknek a képze- letbeli elhelyezkedése, melyek nagy valószínűséggel csak rövid ideig életképesek és csak különleges környezetben észlelhetőek.
Prof. Theodor Benfey az energiaszinteknek megfelelően, spirális a- lakban, lényegében nö- vekvő sorrendbe rakta az elemeket. Azok az elemek, amik sok elekt- ronnak adnak helyet a d és f orbitáljaikon, a ki- türemkedésekben kap- tak helyet. Ezen felül még látható azoknak az elemeknek a képze- letbeli elhelyezkedése, melyek nagy valószínűséggel csak rövid ideig életképesek és csak különleges környezetben észlelhetőek. | ||
| Janet spirális periódusos táblázata |



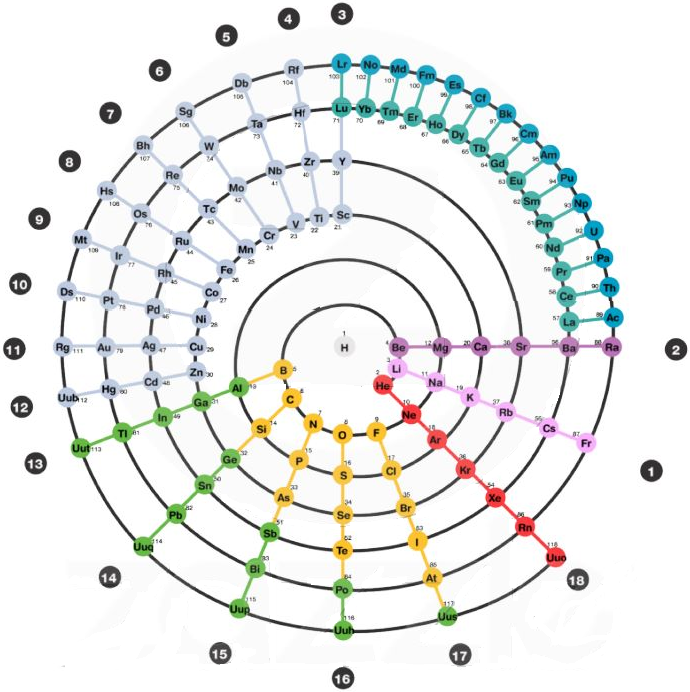
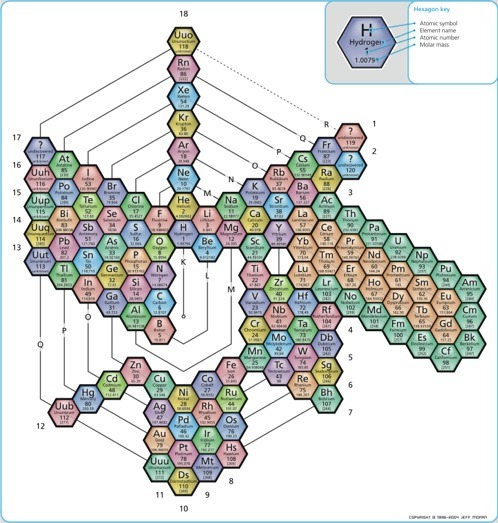
 |
| Clark modell |

| A kiegészítet Mengyelejev féle általános periódusos rendszer |
... és a felfedezések még nem értek véget
Ami a kémiai elemeket illeti, vehetjük úgy, hogy nagyjából minden elemet ismerünk, ami a természetben megtalálható. Az anyag egy másik formája viszont még mindig ismeretlen. Ezek a részecskék. Néhányat ugyan már ismerünk: proton, elektron, neutron, de van még mit felfedezni közülük. Ez már inkább a kvantumtudományok területe, de ugyancsak az anyag keretei közé tartozik. Tehát az elemek rendszere elkészült, most következik a részecskék táblázatának összeállítása, ami hatalmas lehetőségeket hordoz magában.
A részecskék rendszerének összeállításához az első lépés talán Garret Lisinek köszönhető. Lisi az E8 nyolcdimenziós szerkezetének 248 pontjába elkezdte beírni a 40 ismert részecske különböző kvantumtulajdonságú változatait. Azonban maradt húsz üres hely, amelybe feltételezett részecskéket írt be. Ez hasonló ahhoz, amit Mengyelejev csinált 1869-ben.
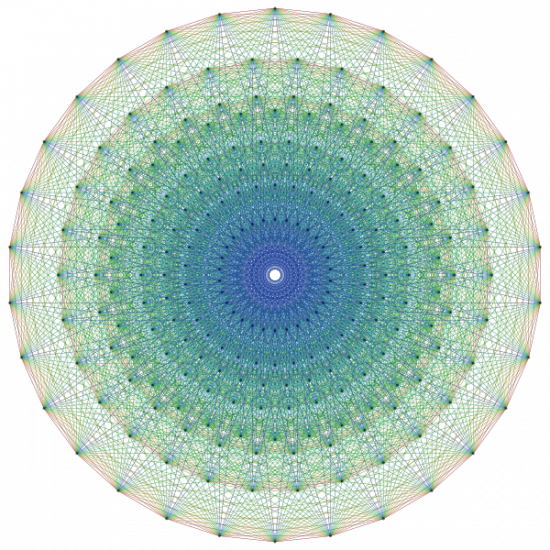 |
| Az E8 egyik ábrázolása |
A részecskékről szóló forrás a következő linken található:
További hivatkozások:
Simon L. Z.